光声成像(PAI)是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法。光声成像结合了纯光学组织成像中高选择特性和纯超声组织成像中深穿透特性的优点,可得到高分辨率和高对比度的组织图像,从原理上避开了光散射的影响,突破了高分辨率光学成像深度“软极限”(~1 mm),可实现50 mm的深层活体内组织成像。
活性氧(ROS:O2▪-, HO▪, OCl-、H2O2和HO2▪)和活性氮(RNS:NO▪, NO2、ONOO-和NO3-)是细胞的重要调节代谢产物,与许多病理过程(如炎症和癌症)和治疗过程(如化疗和放疗)有关。由于ROS和RNS反应性强且寿命短,通常不能直接检测到它们。
本文中,作者设计了一种可逆激活的探针,在与ROS反应后,这些探针可以利用生物还原剂恢复到初始状态,但在较高浓度的ROS中是持久的。据报道,ROS可降解的小分子有机染料(SODs)可用于这种可逆ROS检测(如图1A)。之前的研究表明,丁基羟基甲苯(BHT)修饰的卟啉染料能可逆地捕获ROS,形成新的(半)稳定状态,改变吸收和PA性质(如图1B)。这类卟啉染料虽然在体外对超氧化物检测具有高度有效和选择性,但由于高疏水性和结构修饰方面的阻碍,不适合在体内应用。为了克服这一限制,作者采用了一种更具生物相容性和可修饰的染料,即氟硼二吡咯烷(BODIPY)。
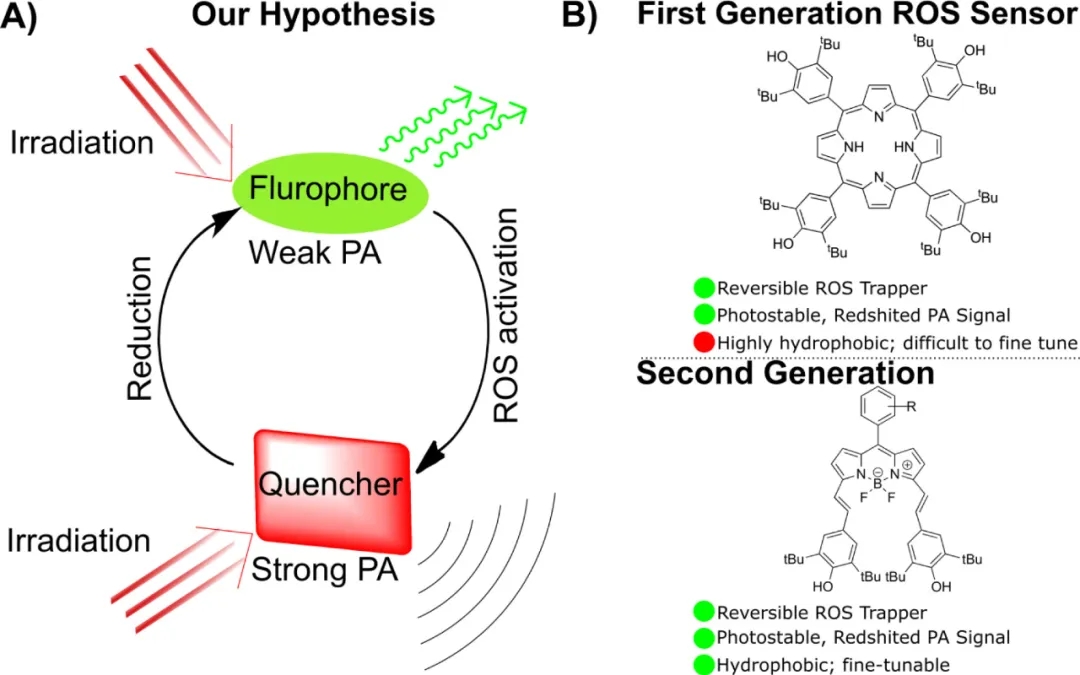
图1. 基于BODIPY的可逆探针的设计策略
作者合成了一系列基于BODIPY的探针用于检测ROS(如图2),并研究了它们的光谱性质,如图3,在疏水性系列3a–3d中,空间体积较大的烷基(R=H到tBu)降低了探针的摩尔吸收系数(ε),并加宽了吸收带,吸收峰略有红移。亲水性系列5a–5d显示出类似趋势。有趣的是,可以观察到ε先降低(R=H到iPr),然后再次增加(R=tBu),这归因于具有更大体积tBu基团引起的聚集减少。此外,随着烷基体积(H到tBu)的增加,这两个系列探针的荧光量子产率(φfl)均呈下降趋势,在3a–3d中分别为25–3.2%,在5a–5d中分别为2.5%-0.1%。3d的吸收从pH 2到9没有显示出显著变化,但从pH 10以上产生了变化。
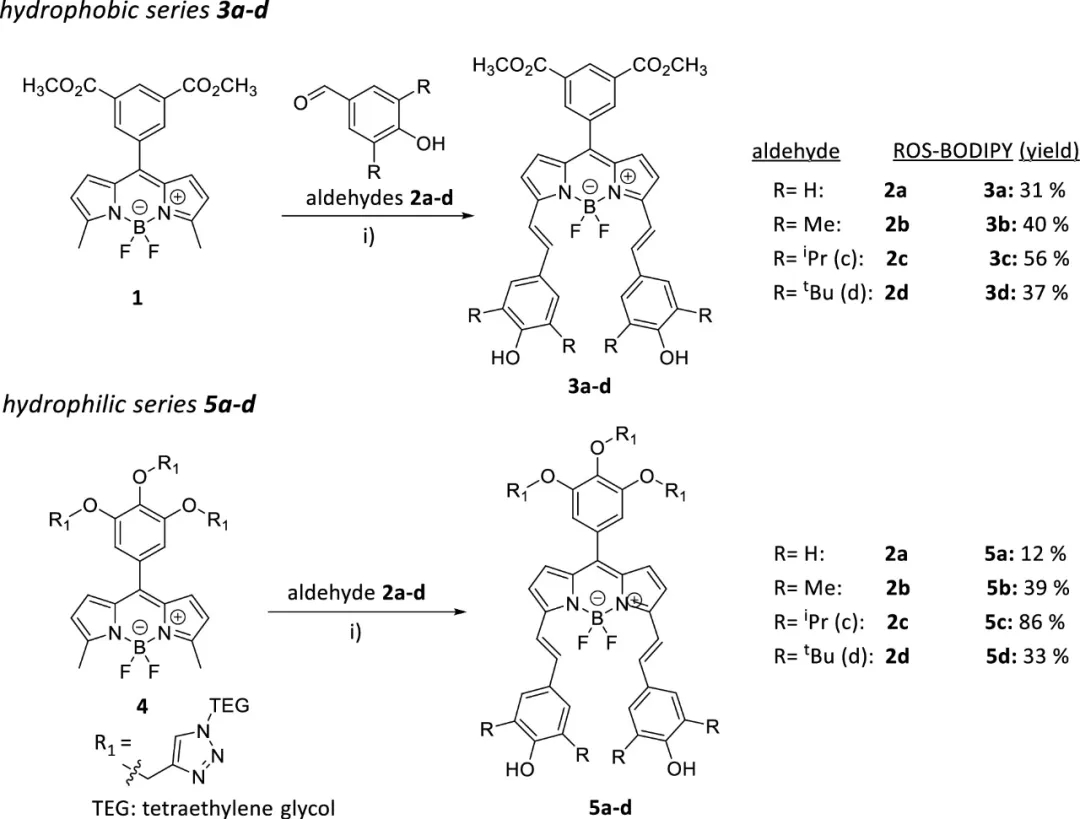
图2. 一系列基于BODIPY的可逆探针的结构式
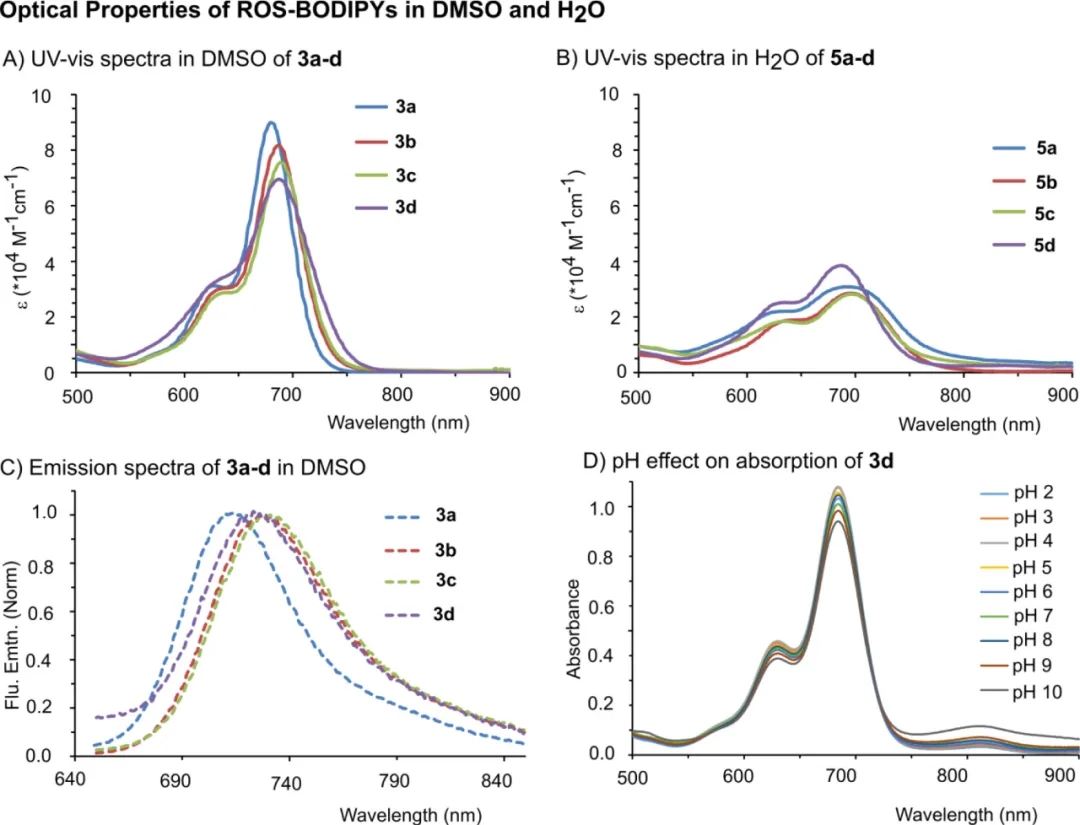
图3. 3a–3d、5a–5d的光谱性质
在对探针进行表征后,作者研究了探针对ROS的响应。在所有探针中,3d对ROS的响应前后的吸收变化最显著(如图4A)。优异光声成像剂的主要特性之一是高ε,因此在THF溶液中对3d的ε进行定量。作者发现,在捕获O2▪-后,ε从69000 M–1 cm–1增加到80000 M–1cm-1,吸收峰也表现出110 nm的红移(从700 nm到810 nm)。更重要的是,与O2▪-反应后,3d的吸收光谱与光声光谱很好地相关(如图4B)。此外,当浓度为0.5-15μM时,PA强度显示出与浓度的线性相关性(如图4C),满足理想CA的要求。使用激光连续照射5分钟来证实3d的光稳定性,观察到3d▪没分解(如图4d),而3d和ICG分解迅速。
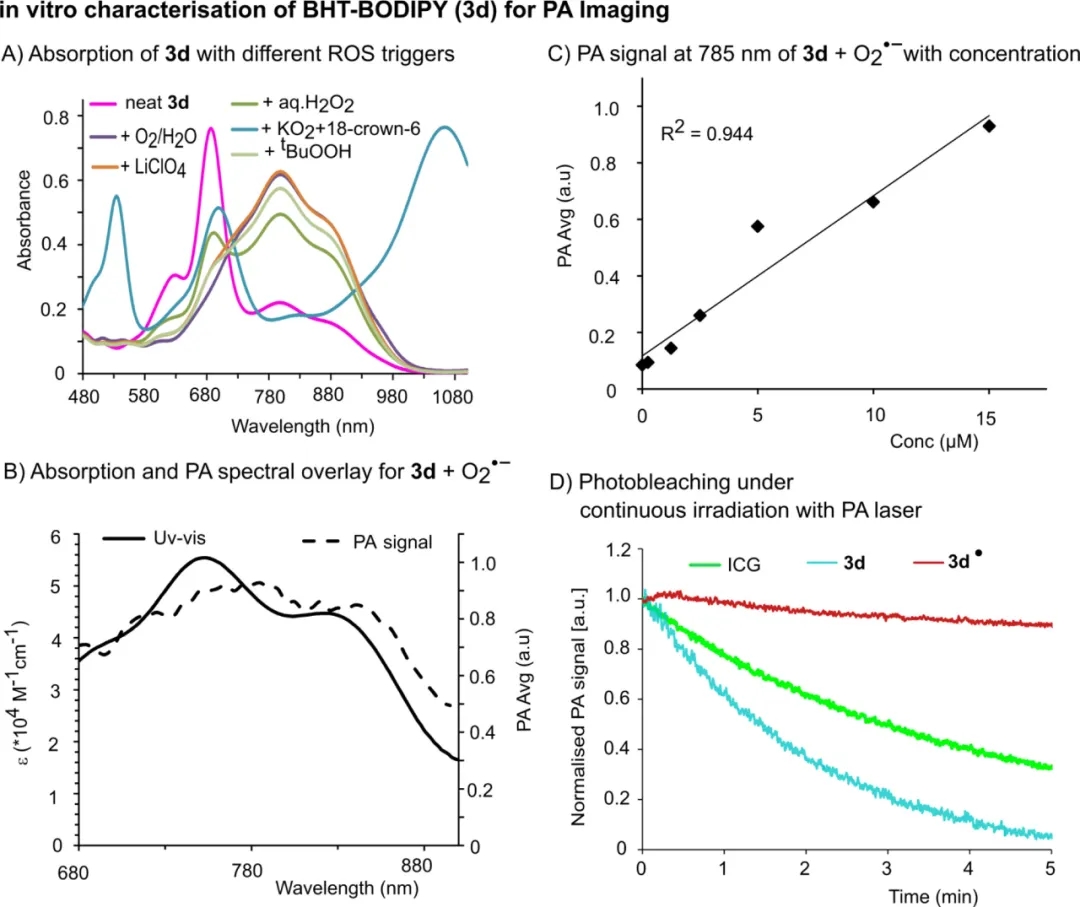
图4. 3d对ROS的光谱响应
为了验证3d的可逆性,首先用KO2处理3d,然后用柠檬酸滴定(如图5C、5D)。吸收光谱表明,添加柠檬酸后,3d▪转化为3d。即自由基可以被维生素C或柠檬酸等天然抗氧化剂中和,防止探针的积累和随后在ROS水平低的环境中检测ROS。只有存在大量ROS的情况下,才会出3d▪的积累(如图5A、5B)。这对于探针作为医学诊断剂的应用非常重要,因为它允许在生理氧化还原组织环境中实现平衡的“开/关”切换行为,从而在健康组织中产生低背景信号,并使检测过程不那么依赖时间。
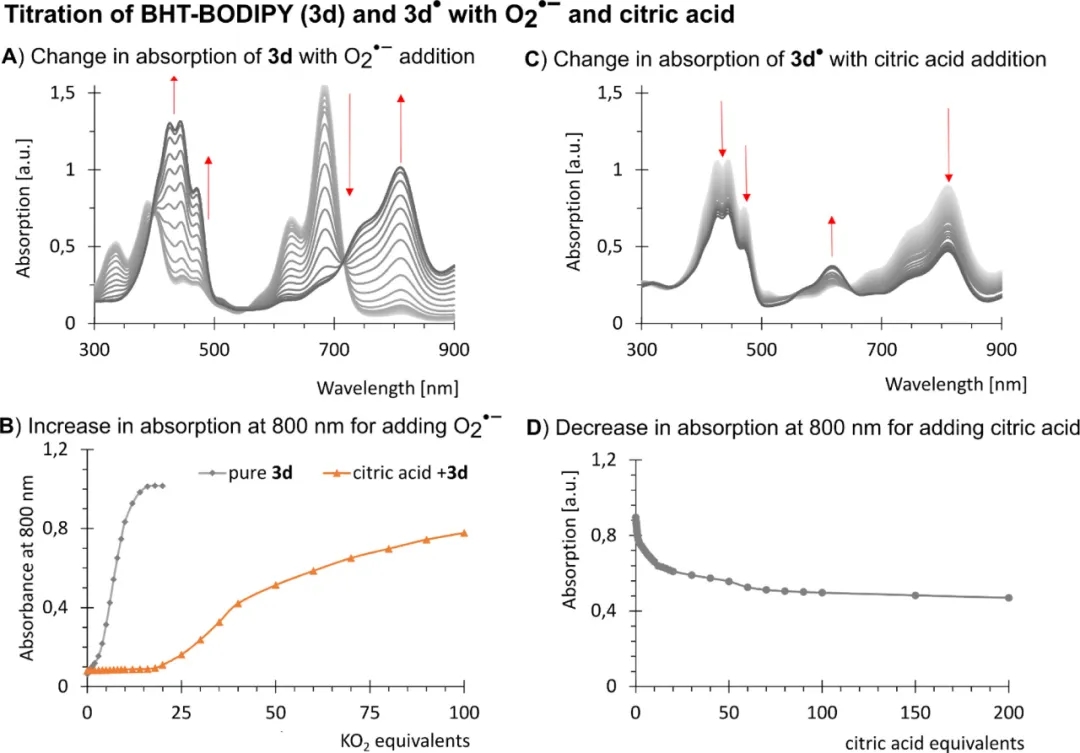
图5. 通过光谱变化来验证3d的可逆性
最后,作者建立了小鼠皮下炎症模型,3d和O2▪-激活的3d▪分别注射在同一老鼠的左侧和右侧。如图6A,可以清楚地看到,只有3d(动物的左侧)产生荧光信号,2小时后,3d▪的荧光信号出现轻微恢复,这表明3d的可逆性,即氧化还原环境中的“开/关”切换。在多光谱光声断层扫描(MSOT)中,同一只小鼠的PAI显示,小鼠左侧中有强的光声信号,右侧没有信号。反之亦然,右侧有PA信号,而左侧显示负信号。
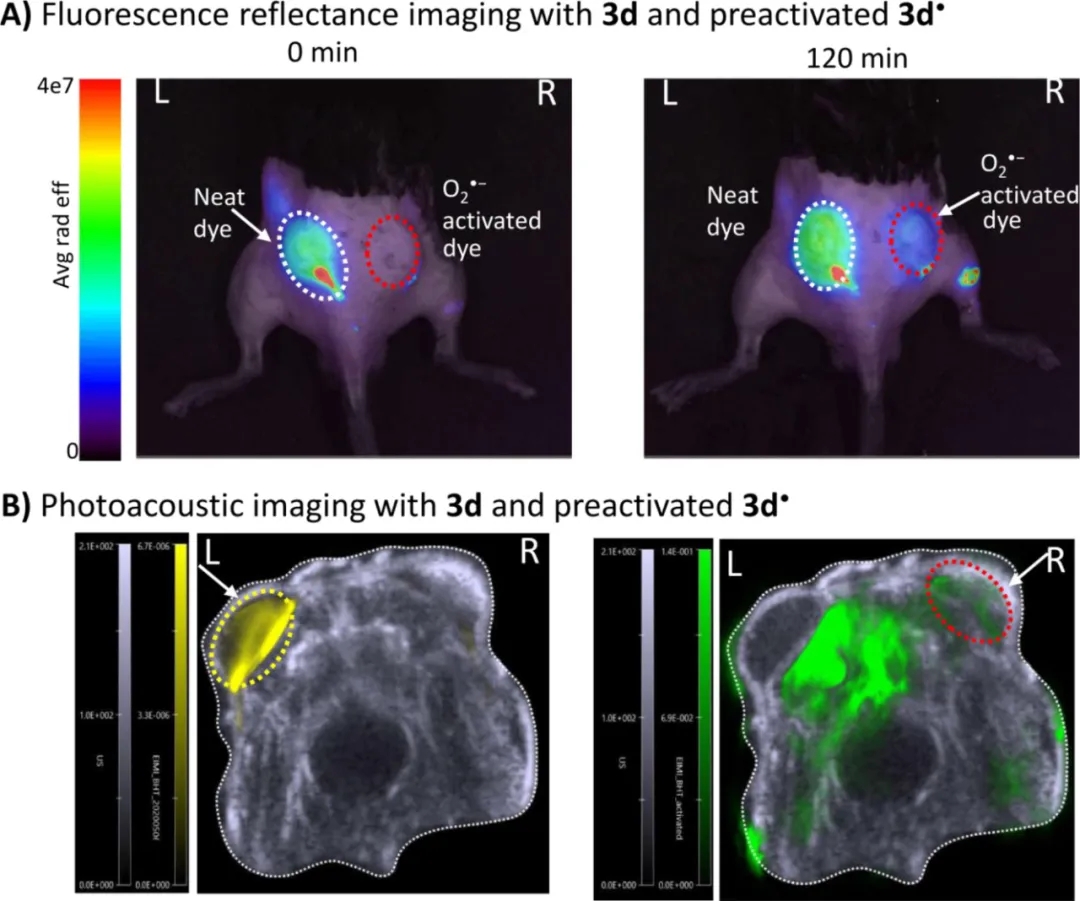
图6. 通过体内实验来验证3d的可逆性
DOI:10.1021/acssensors.1c01674











