Bodipy-C12 脂代谢先于伊美司他诱导的铁死亡
BODIPY-C12 是一种含有亲脂性尾巴的硼-二溴乙烯衍生物 (激发波长 490 nm)。BODIPY-C12 是一个疏水分子,对周围环境敏感,可用于量化粘度。
澳大利亚昆士兰医学研究院(QIMR Berghofer Medical Research Institute)Steven W. Lane教授课题组在国际知名期刊Nat Cancer在线发表题为“Imetelstat-mediated alterations in fatty acid metabolism to induce ferroptosis as a therapeutic strategy for acute myeloid leukemia”的论文。
端粒酶使包括急性髓细胞白血病(AML)在内的大多数癌症能够复制永生。伊美司他是一种最新的端粒酶抑制剂,对骨髓增生症和骨髓增生异常综合征具有临床疗效。本文作者开发了一种AML患者来源的异种移植物资源,并结合功能遗传学进行综合基因组学、转录组学和脂质组学分析,以确定伊美司他有效的关键介质。
在一项针对患者来源的异种移植物的随机II期样临床前试验中,伊美司他有效地减少了AML负担,并优先靶向含有突变NRAS和氧化应激相关基因表达特征的亚组。无偏见的全基因组CRISPR/Cas9编辑将铁死亡调节因子鉴定为伊美司他有效的关键介质。伊美司他促进含有多不饱和脂肪酸的磷脂的形成,导致脂质过氧化和氧化应激水平过高。对铁死亡的药理学抑制降低了伊美司他的疗效。利用这些机制见解开发了一种优化的治疗策略,使用氧化应激诱导化疗使患者样本对伊美司他敏感,从而使AML的疾病得到实质性控制。
1、生成全面的AML患者来源的异种移植物(PDXs)资源
从成功植入NSGS的AML患者的个体样本中,随机选择30个样本,并根据临床参数进行表征,包括患者年龄、性别、ELN2017风险、世界卫生组织疾病分类和通过转录和突变测序获得的分子图谱(图1a–c)。代表了所有ELN2017预后风险和年龄类别;17个样本来自女性,13个样本来自男性AML患者捐献者(图1b)。在NPM1、DNMT3A和FLT3基因座中最常检测到致癌突变,总体而言,该AML PDX资源概括了在大型临床AML队列中观察到的遗传异常(图1c)。
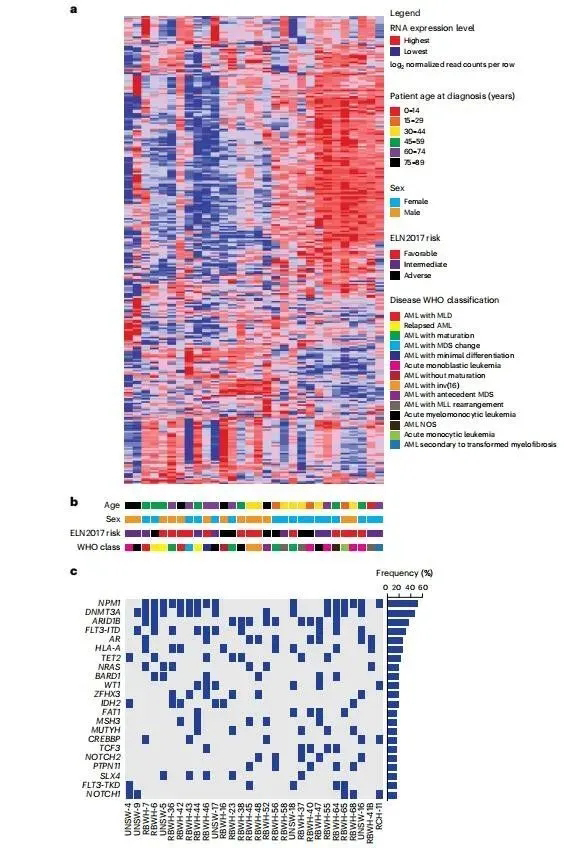
图1. AML患者样本的综合分析
2、伊美司他治疗AML PDX的II期临床前试验
为了测试伊美司他治疗AML的临床前疗效,将来自AML患者的30个具有特征的个体样本分别移植到NSGS受体。一旦检测到AML负荷,将PDX随机分组,并用伊美司他治疗,直到疾病发作或达到至少30d的生存益处。与PBS处理的PDX相比,伊美司他的中位生存期显著延长(图2a)。与载体治疗的受试者相比,AML负荷在伊美司他中显著较低(图2b)。
此外,与载体对照相比,接受伊美司他治疗的受试者的终点外周血供体嵌合、骨髓细胞和供体嵌合以及AML患者来源细胞的绝对数量显著减少(图2c–f)。此外,伊美司他治疗显著降低了脾脏AML供体嵌合(图2g)。接下来,作者评估了与白血病启动活性相关的AML表面标志物表达(图2h)。伊美司他显著减少了CD34+CD38-白血病干细胞富集的脾AML细胞群(图2i)。
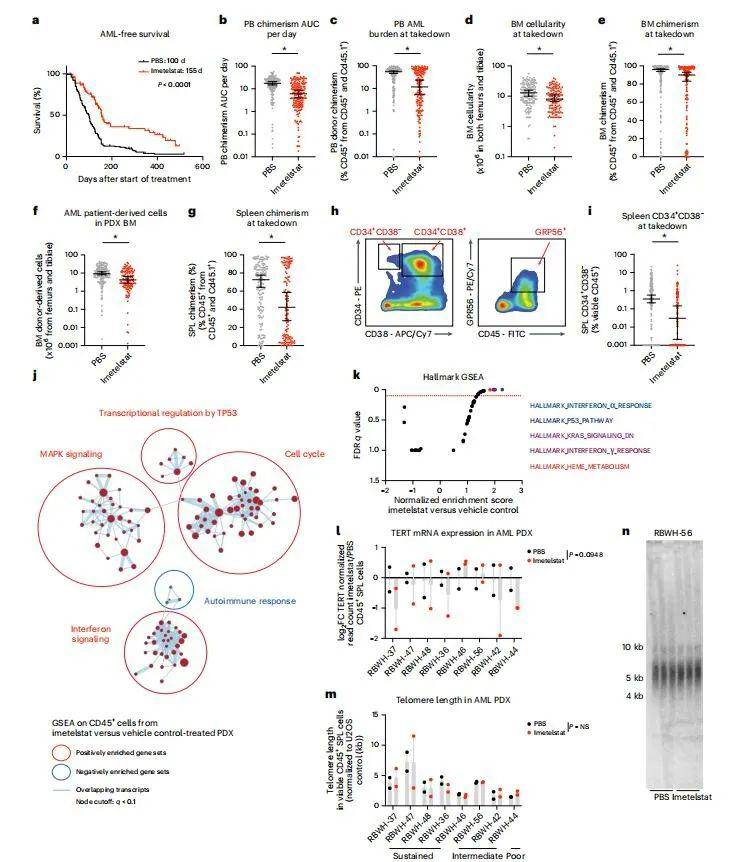
图2. 伊美司他在AML PDX的随机II期临床前试验中的疗效
接下来,在来自体内AML患者的八个随机选择的个体样本的PDX队列中评估了伊美司他治疗的转录效果。与载体对照处理的PDX相比,来自伊美司他处理的AML供体细胞中注释为干扰素信号、细胞周期、TP53的转录调节和MAPK信号的基因表达特征显著富集(图2j,k)。与载体处理的PDX脾脏相比,来源于伊美司他处理的AML供体细胞中TERT信使RNA表达水平呈下降趋势(图2l)。值得注意的是,与载体处理组相比,伊美司他处理组的端粒长度相似(图2m,n)。
3、识别伊美司他关键效应子的CRISPR/Cas9筛选
为了以公正的方式研究伊美司他在AML中的作用机制,作者应用Brunello gRNA文库作为阳性选择筛选,以鉴定对伊美司他产生耐药性的基因敲除。与载体处理和对照培养物相比,特异性gRNA在Brunello转导的伊美司他抗性培养物中选择性富集。RIGER和STARS基因排序算法联合确定了七个显著的基因:脂肪酸去饱和酶2(FADS2)、酰基辅酶A合成酶长链家族成员4(ACSL4)、线粒体内膜转座酶17A(TIMM17A)、晚期内体/溶酶体衔接子、MAPK和MTOR激活剂1-3(LAMTOR1、LAMTOR2、LAMTOR3)以及肌球蛋白调节轻链相互作用蛋白(MYLIP;图3a)。分析表明,这七个基因在调节脂质代谢、铁离子结合、线粒体基质和溶酶体生物发生和定位方面存在密切的功能关系(图3b)。
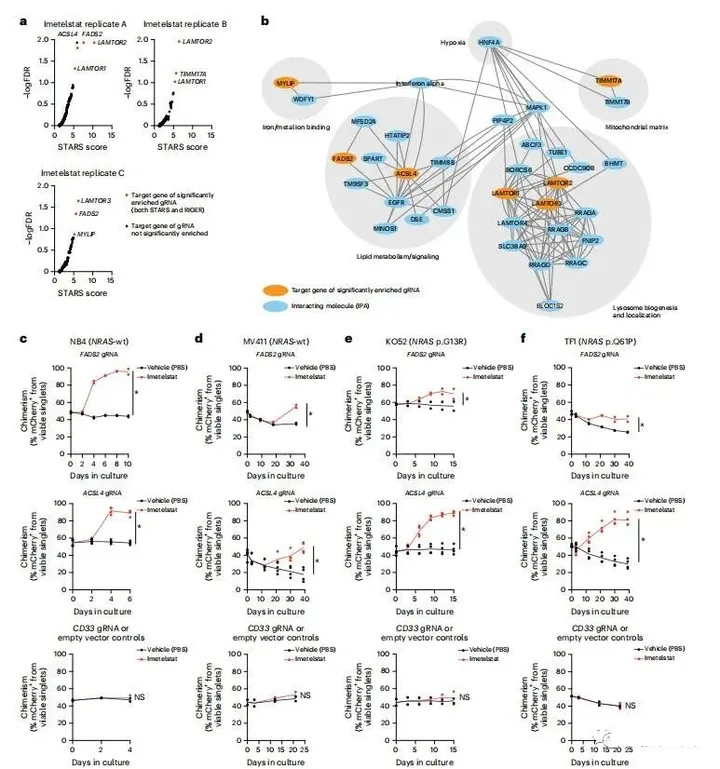
图3. 利用全基因组CRISPR/Cas9编辑鉴定伊美司他疗效的关键介质
接下来,作者旨在验证在表达NB4和MV411的NRAS野生型以及NRAS突变体KO52(p.G13R)和TF1(p.Q61P)AML细胞系中使用单引导RNA(sgRNA)介导的编辑鉴定的最显著的基因(FADS2和ACSL4)。作者进行了竞争分析,以证实在所分析的所有AML细胞系中,FADS2或ACSL4的功能缺失编辑在伊美司他作用下具有竞争性生长优势(图3c–f)。观察到的效应是靶特异性的,因为当使用CD33敲除或空载体对照时,没有观察到在伊美司他作用下的竞争性生长(图3c–f)。这些结果表明,FADS2或ACSL4的功能缺失编辑在伊美司他作用下赋予竞争性生长优势,鉴定ACSL4和FADS2为伊美司他在AML中的疗效的介质。
4、伊美司他是铁死亡的有效诱导剂
ACSL4和FADS2编码调节含多不饱和脂肪酸(PUFA)磷脂合成的关键酶。对593种脂质及其去饱和水平的靶向脂质组学分析表明,伊美司他处理和FADS2编辑对细胞脂质组学有明显影响,伊美司他处理的空载体对照AML细胞与载体处理的空矢量对照和FADS2-编辑的细胞显示出最大差异。此外,与载体对照处理的NB4细胞相比,在伊美司他处理的细胞中,含有具有三个不饱和键的脂肪酸的磷脂显著富集,并且这种脂质去饱和的富集通过FADS2编辑而减少(图4a)。总之,这些数据证明了伊美司他以FADS2依赖的方式诱导PUFA磷脂合成。
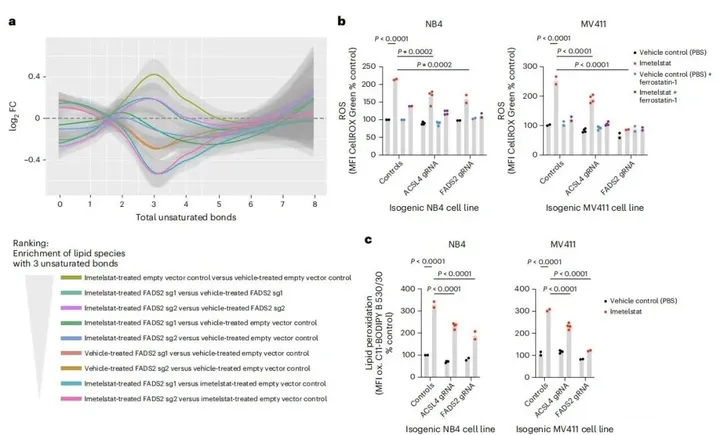
图4. 伊美司他是铁死亡的有效诱导剂
为了测试伊美司他是否诱导脂质过氧化,用C11-BODIPY处理了各种AML细胞系,C11-BODPPY是一种荧光脂肪酸探针,在氧化时其发射光谱从红色变为绿色。在测试的所有四种AML细胞系中,伊美司他处理导致氧化脂肪酸探针的平均荧光强度(MFI)显著增加,表明伊美司他在体外诱导AML细胞中的脂质过氧化(图5b)。
接下来,评估了活性氧水平是否也受到伊美司他的影响。使用CellROX Green来测量ROS的产生,发现其MFI被伊美司他增加,并且当在与CellROX Green的孵育步骤中添加脂质ROS清除剂ferrostatin-1时,这种增加减少,这表明伊美司他在体外主要增加AML细胞系中的脂质ROS水平(图5a)。在ACSL4或FADS2功能缺失编辑的AML细胞系中,脂质过氧化和脂质ROS的产生均显著减少,这表明伊美司他诱导的脂质过氧化及脂质ROS产生在体外依赖于功能性FADS2和ACSL4(图4b,c)。
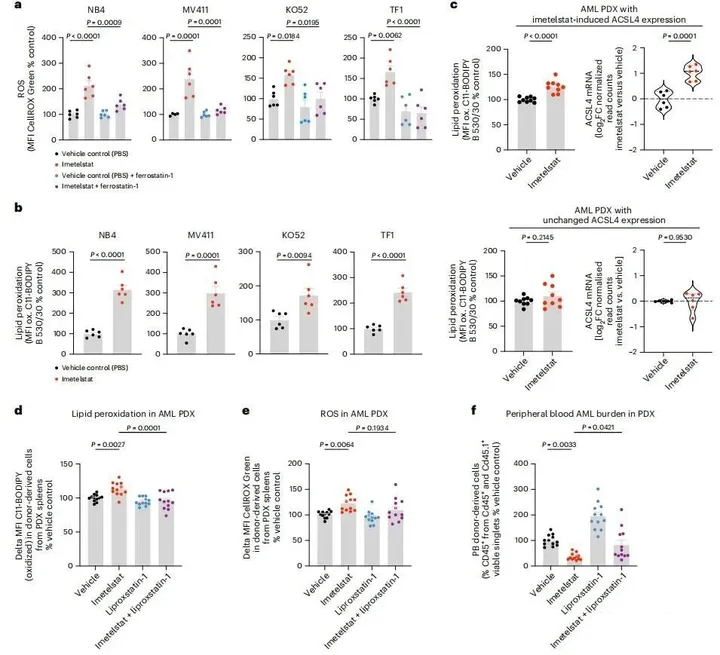
图5. 脂质ROS清除降低伊美司他疗效
在体内AML PDX中,伊美司他诱导的脂质过氧化与ACSL4表达增加有关(图5c)。利普司他汀治疗阻止了伊美司他驱动的脂质过氧化和ROS产生(图5d,e)。通过外周血AML负荷测量,体内利普司他汀治疗降低了伊美司他在PDX中的疗效(图5f)。总之,这些数据证明伊美司他是通过ACSL4和FADS2介导的PUFA代谢改变、过度脂质过氧化和氧化应激而引起铁死亡的有效诱导剂。
5、脂质吞噬先于伊美司他诱导的铁死亡
通过整合转录组学和功能遗传学,旨在研究伊美司他诱导铁死亡的机制。用Brunello文库CRISPR/Cas9敲除筛选数据覆盖了来自伊美司他和载体处理小鼠的体内AML PDX RNA-seq数据集,并鉴定了11个伊美司他靶点候选物(图6a)。其中两种,VIM(波形蛋白)和LMNA(层粘连蛋白A/C),是常见调节模块的一部分(图6a),最近被鉴定为端粒G-四链体结合蛋白。
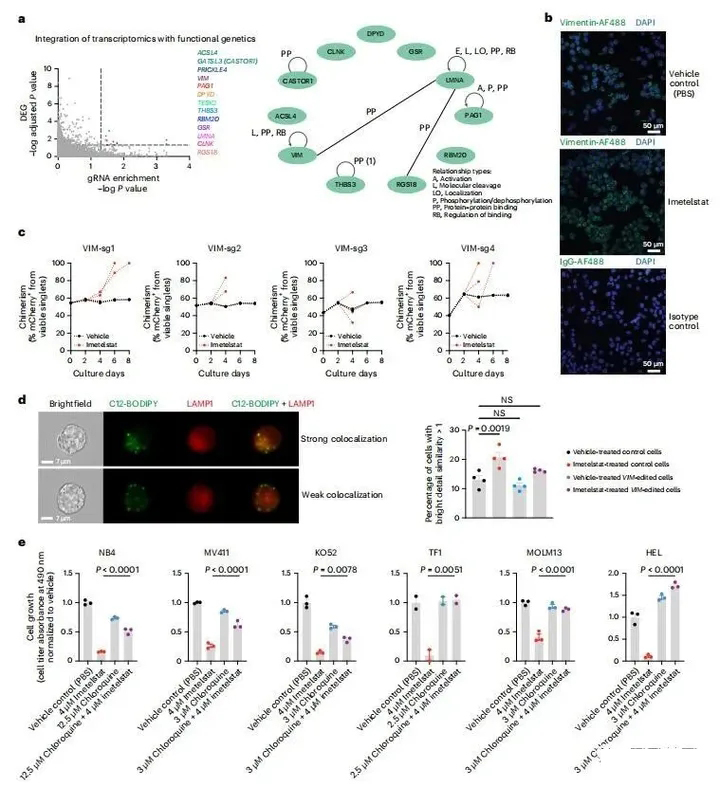
图6. 转录组学与功能遗传学的综合分析
脂滴可以进行选择性自噬(脂吞噬),从而导致铁死亡的诱导。假设伊美司他诱导的PUFA磷脂合成、氧化和铁死亡可能是由脂吞噬引起的。波形蛋白在体外AML细胞中以蛋白质水平高度表达(图6b),波形蛋白的功能编辑缺失导致AML细胞在伊美司他压力下具有适度的竞争性生长优势(图6c)。
接下来,使用C12-BODIPY(一种用于脂滴的荧光脂肪酸探针)和晚期内体标记LAMP1来评估脂吞噬。成像流式细胞术显示,脂滴与晚期内体标记LAMP1的共定位显著增加,表明脂吞噬增加(图6d)。值得注意的是,在所有测试的AML细胞系中,氯喹减少了伊美司他诱导的细胞死亡(图6e)。这些结果为脂吞噬诱导的铁死亡在伊美司他的AML作用机制中的作用提供了证据,该机制是由于G-四链体介导的对脂滴结构成分的干扰而导致的脂滴稳态受损。
6、氧化应激特征区分持续反应者
接下来的目标是通过分析基线AML患者个体样本的数据来确定对伊美司他治疗的反应和耐药性的遗传生物标志物,这些数据是通过使用585个在血液系统恶性肿瘤中频繁突变的基因的综合组织进行基因组测序产生的。在信号传导或细胞粘附/代谢中注释的基因中的致癌突变在持续中比对伊美司他的不良反应更频繁地观察到(图7a)。
.jpg)
图7. 突变NRAS和氧化应激基因表达特征与对伊美司他的持续反应相关
突变NRAS与对伊美司他治疗的反应增强有关。与含有AML PDX的野生型NRAS相比,AML负担减少和存活率提高证明了这一点(图7b,c)。在基线时从AML患者的个体样本中获得的RNA-seq数据的基因集富集分析(GSEA)显示,与对二甲司他的不良反应相比,持续应答者具有与翻译/病毒感染相关的基因特征的正富集以及与细胞周期、抗病毒免疫、跨膜转运和血红素清除相关的负富集(图7d)。与对伊美司他的不良反应相比,注释为细胞凋亡、干扰素-α反应、DNA修复、TP53途径、过氧化物酶体、脂肪酸代谢和ROS途径的基因集在显著富集(图7e)。
接下来,研究了基线端粒长度是否可以预测伊美司他反应。端粒长度通过端粒限制性片段(TRF)分析确定,端粒峰值长度在2.7到12kb之间变化(图7f)。30个AML患者样本中有5个含有多个端粒长度不同的亚克隆(图7f)。总的来说,基线端粒长度和伊美司他反应之间没有相关性(图7f)。这些数据表明伊美司他对很大一部分AML PDX有效。此外,对伊美司他的持续反应与基线端粒长度无关,并与存活率、突变NRAS和注释为氧化应激的基线分子特征的显著改善有关。
7、氧化应激诱导AML PDX对伊美司他敏感
为了测试氧化应激诱导治疗是否能使AML细胞对伊美司他治疗敏感,用氧化应激诱导标准诱导化疗(阿糖胞苷联合阿霉素)预处理AML细胞系,随后改用伊美司他治疗。标准诱导化疗以剂量依赖性方式显著增加ROS水平,导致AML细胞系中细胞死亡增加(图8a、b)。
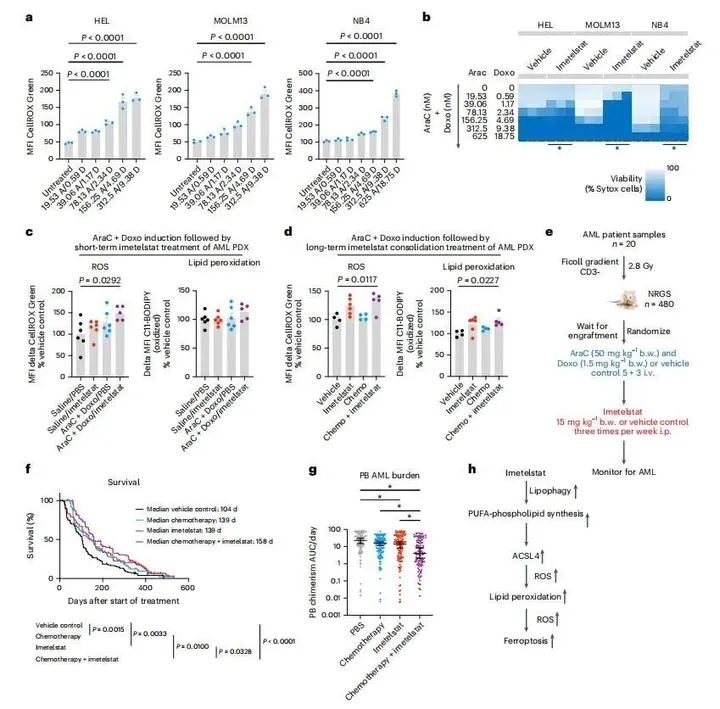
图8. 氧化应激诱导和标准化疗使AML细胞对伊美司他敏感
在一项使用NRAS野生型AML PDX模型的研究中,单剂量标准诱导化疗后单剂量伊美司他导致体内PDX中AML患者衍生细胞的ROS水平显著增加(图8c)。在这个早期时间点,治疗组之间的脂质过氧化没有显著差异(图8c);然而,经过一个完整的诱导化疗周期,然后用伊美司他巩固治疗延长治疗后,脂质过氧化和ROS水平均显著升高(图8d)。
最后,在来自20个不同AML患者样本的不同PDX队列中,在伊美司他治疗之前,依次给予氧化应激诱导标准诱导化疗(图8e)。与伊美司他单药治疗、单独诱导化疗或载体对照相比,联合治疗显著延长了生存期(图8f)。与单药治疗或载体治疗的对照组相比,联合治疗组的AML负荷显著降低(图8g)。这些数据表明,使用标准诱导化疗来诱导氧化应激并使AML细胞对伊美司他诱导的脂质过氧化和铁死亡敏感,伊美司他和化疗的合理测序可显著改善AML的疾病控制(图8h)。
8、结论
总之,伊美司他是铁死亡的有效诱导剂,可有效减少AML负担,并延迟氧化应激诱导化疗后的复发。临床试验将探讨伊美司他对AML的疗效,并可能将重点放在该化合物上,将其作为预防复发的巩固策略,可能与靶向治疗一起改善AML患者的预后。

