如何正确区分PCR、qPCR、RT-PCR、RT-qPCR、Real-Time PCR?
在学习过程中,我们经常会遇到各种PCR字眼,什么qPCR、RT-PCR、RT-qPCR、Real-Time PCR,好多同学看的头晕眼花也没弄明白这几种PCR有什么区别,那你呢?你了解PCR这个大家族吗?还在傻傻分不清吗?

一、什么是PCR?
图1 PCR仪器的发展历程(Lee NY., 2018)
二、PCR的原理
PCR的基本原理与DNA的体内复制相类似,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性、退火和延伸三个基本反应步骤构成:
①模板DNA的变性:模板DNA经高温(95℃左右)加热一定时间后,使其解离成单链,以便它与引物结合;
②模板DNA与引物的退火(复性):将温度降至55℃左右时,引物与模板DNA单链按碱基互补配对的原则结合;
③引物的延伸:再将温度调至72℃左右(DNA聚合酶最适反应温度),DNA模板和引物结合物在Taq DNA聚合酶的作用下,按碱基配对与半保留复制原理,沿着磷酸到五碳糖(5'→3')的方向合成一条新的与模板DNA链互补的半保留复制链。这样经变性、退火和延伸重复若干个循环后,就能将待扩目的基因扩增放大几百万倍。
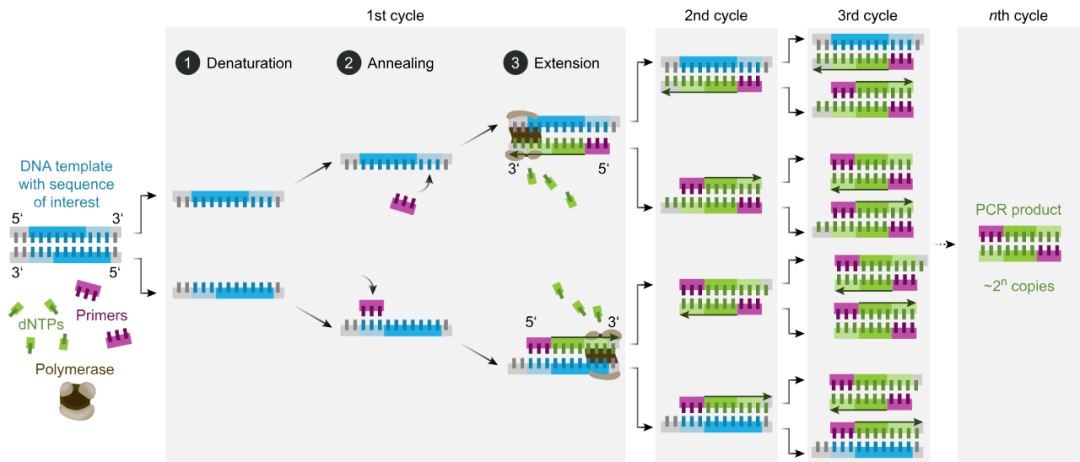
图2 PCR的基本反应步骤(图片源自:Wikipedia)
三、PCR的分类
1.普通 PCR
普通PCR即一代PCR,使用普通PCR扩增仪扩增靶基因,并通过琼脂糖凝胶电泳对产物进行定性分析。
2.实时荧光定量PCR(Quantitative Real-time PCR, qPCR)
实时荧光定量PCR,也叫Real-Time PCR,即二代PCR,是指在PCR扩增反应体系中加入荧光染料或者荧光基团,在整个PCR过程中通过收集荧光信号实时监测每一个循环中扩增产物量的变化,最后通过标准曲线和CT值对待测样品进行定量分析。qPCR常用的有两种方法:SYBR Green法和TaqMan探针法。
①荧光染料法(SYBR Green):SYBR Green Ⅰ是荧光定量PCR中最常用的荧光染料,它能与所有的双链DNA结合。在PCR反应体系中,加入SYBR Green Ⅰ,它就会在过程中与双链DNA结合,从而产生荧光信号。因此,反应中发出的全部荧光信号就会与反应中双链DNA的量呈正比,荧光强度也会随着产物的增加而增加。但是由于染料与双链DNA是非特异性结合,因此可能产生假阳性的结果。
优点:价格相对较低;使用方便;对DNA模板没有选择,通用性好;检测灵敏度高。
缺点:可能产生假阳性结果,需要通过熔解曲线分析识别扩增产物的特异性;需要不断优化反应体系以降低非特异性扩增;不适合进行多重qPCR检测。
②荧光探针法(TaqMan技术):TaqMan探针是最早用于定量的方法,也是临床检测中最常用的检测方法。PCR扩增时,加入一对引物的同时再加入一个特异性的荧光探针。该探针是一个寡核苷酸,5'端标记一个荧光报告基团(Reporter, R),3'端标记一个淬灭基团(Quencher, Q)。当探针完整时,报告基团发射的荧光信号被淬灭基团吸收,以至于无法检测到荧光信号;而当PCR扩增时(在延伸阶段),探针会被Taq酶的5'→3'外切酶活性酶切降解,使报告基团和淬灭基团分离,报告基团发射底的荧光不会再被吸收,从而可以在荧光监测系统接收到荧光信号,即每扩增一条DNA,就形成一个荧光分子,PCR产物的形成与荧光分子的形成完全同步,PCR产物越多,荧光信号累积的越多,荧光强度越大。
优点:检测特异性强;灵敏度高;适合进行多重qPCR检测;PCR后续无需处理,节省时间和原料成本。
缺点:需要根据不同的序列,合成不同的探针;探针的水解依赖Taq酶外切酶的活性,定量时容易受试剂和酶性能影响;淬灭难以彻底,本底较高;检测结果很难判断实际的扩增特性。
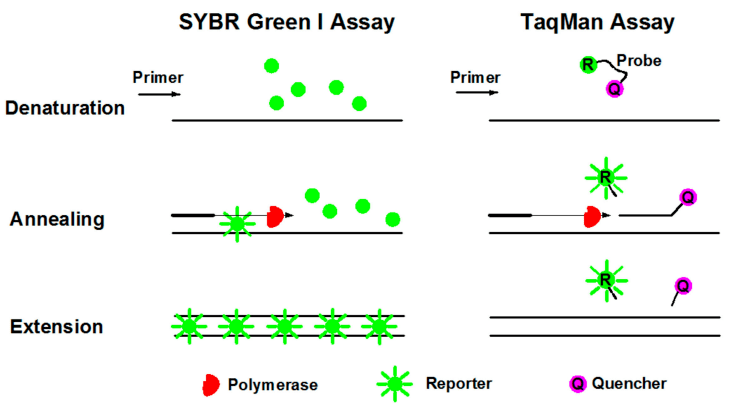
图3 荧光染料法和荧光探针法的工作原理(Cao et al., 2020)
注:多重PCR,也称多重引物PCR或复合PCR,是在一个反应体系中加入两对以上引物,同时扩增出多个核酸片段的一种新型PCR扩增技术。
3.数字PCR(Digital PCR, Dig-PCR, dPCR)
数字PCR即三代PCR,是对原始PCR的另一种改进,是一种能够实现核酸绝对定量的精准检测技术,基于泊松分布原理将核酸样品分配到大量独立、平行的微反应单元(纳升级)中,使每个反应室中平均只有一个拷贝或者没有目标DNA分子,然后加入荧光信号进行扩增,从而实现靶标核酸分子的绝对计数,提高检测灵敏度和准确度。
4. 逆转录PCR( Reverse T ranscription - PCR , RT - PCR)
逆转录PCR也叫反转录PCR,将RNA的反转录(RT)和cDNA的聚合酶链式扩增相结合,是PCR的一种广泛应用的变形。在RT-PCR中首先经反转录酶将一条单链RNA逆转录成cDNA,再以cDNA为模板,扩增合成目的片段。作为模板的RNA可以是总RNA、mRNA或体外转录的RNA产物。无论使用何种RNA,关键是确保RNA中无RNA酶和基因组DNA的污染。RT-PCR技术灵敏且应用广泛,可用于检测细胞中基因表达水平,细胞中RNA病毒的含量和直接克隆特定基因的cDNA序列。一般通过一步法或两步法进行,一步法是RT反应和PCR反应在同一试管中进行;而在两步法中两个反应是分开依次进行的。
5.实时荧光定量逆转录PCR(Real-time RT-PCR, RT-qPCR)
Real-time RT-PCR是qPCR和RT-PCR的组合,其中的“RT”是Reverse transcription(逆转录)的意思,所以RT-qPCR就是结合了荧光定量技术的逆转录PCR,即以mRNA或总RNA为模板,先反转录得到cDNA,再以cDNA为模板,通过荧光定量PCR进行定量检测分析。因为RT-PCR只可以定性,但不能进行定量分析。与RT-PCR一样,RT-qPCR定量分析RNA也有两种方法:一步法和两步法。两种方法都需要先将RNA反转录为cDNA,然后再将其作为qPCR扩增的模板,只是一步法中的RT和qPCR在同一试管中进行,两步法中的RT和qPCR是按顺序分开进行。
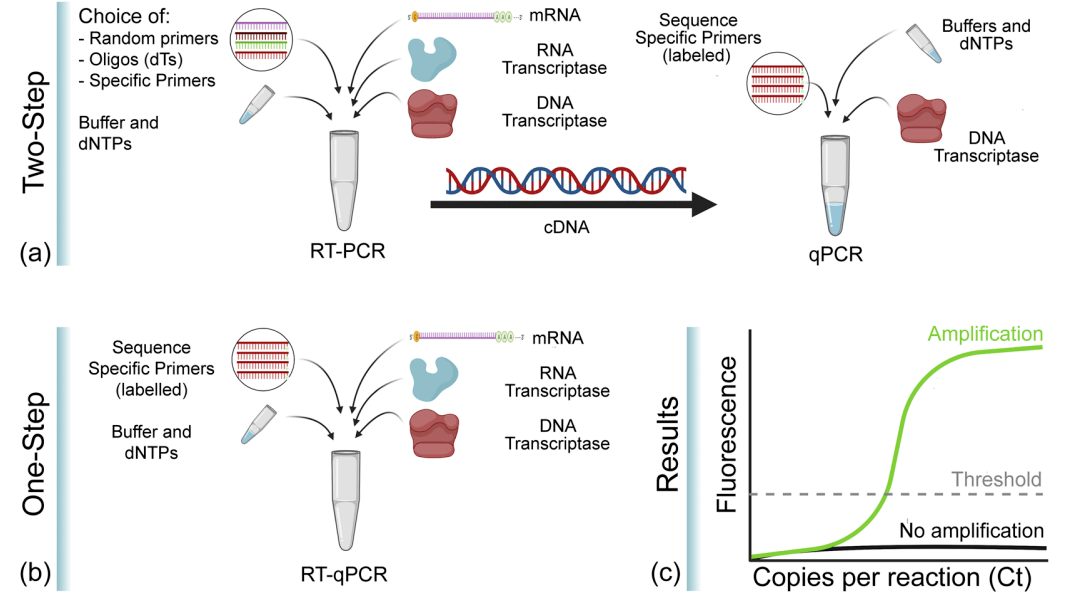
图4 RT-qPCR的一步法和两步法(Soler et al., 2020)
1.PCR,通常指的是普通PCR,以双链DNA为模板,以dNTP为底物,定性扩增双链DNA。
2.qPCR和Real-time PCR,指的是实时荧光定量PCR,以cDNA为模板,以dNTP为底物,对扩增出的DNA进行定量分析。
3.RT-PCR,指的是逆转录PCR,以由mRNA逆转录成的cDNA为模板,以dNTP为底物,进行DNA的扩增,属于PCR的变种,结果只能定性,不能定量。
4.RT-qPCR,指的是实时荧光定量逆转录PCR,是qPCR+RT-PCR的组合,将总RNA或mRNA逆转录成cDNA后再作为模板,以dNTP为底物,进行qPCR的定量分析。
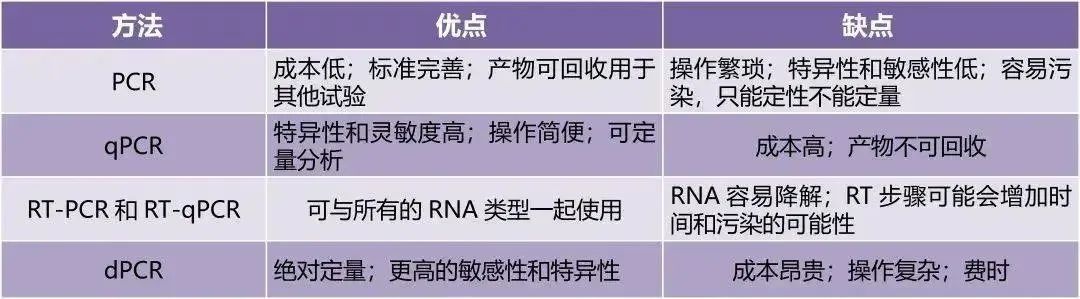
表1 不同PCR方法的主要优缺点
-End-

